IRBバルセロナと国立ゲノム解析センター(CNAG)の研究チームが、転移性大腸腫瘍が2つの相補的なメカニズムを通じて免疫系をブロックする仕組みを明らかにした。
Nature Genetics誌に掲載されたこの研究は、腫瘍内の防御細胞の作用を阻害する重要なタンパク質、オステオポンチンを特定している。研究を主導したのは、IRBバルセロナのエドゥアルド・バトレ博士、アレハンドロ・プラドス博士、CNAGのホルガー・ヘイン博士である。
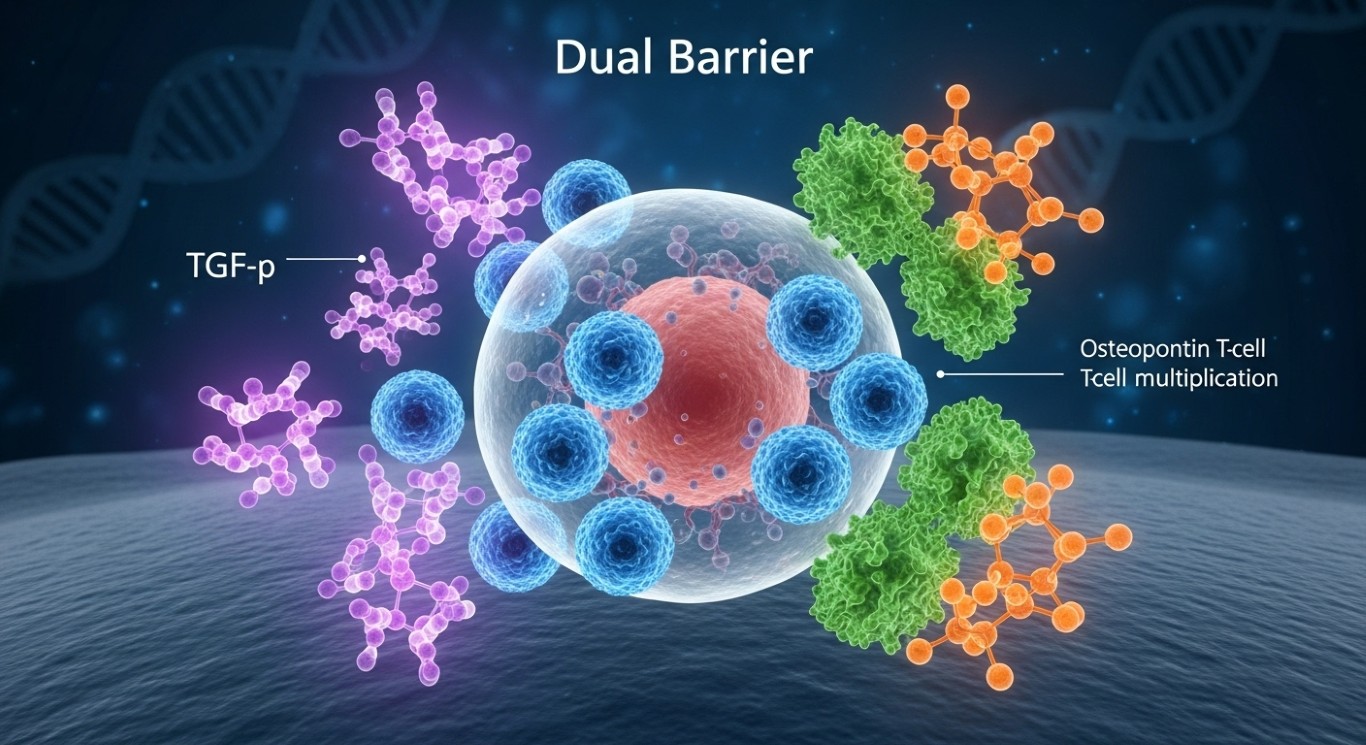
研究では、TGF-βという物質が2つの方法で免疫系をブロックすることを発見した。第一に、TGF-βは血液中のT細胞が腫瘍に到達するのを防ぎ、第二に、マクロファージを修飾してオステオポンチンというタンパク質を産生させ、腫瘍に浸潤したT細胞の増殖を抑制する。
マウスの実験モデルでTGF-βをブロックすると、免疫細胞が腫瘍に大量侵入し、免疫療法との併用で強力な抗腫瘍反応が確認された。この発見により、より多くの転移性大腸がん患者に有効な複合療法の開発が期待される。
From: ![]() Colorectal cancer evades immunotherapy using a dual barrier
Colorectal cancer evades immunotherapy using a dual barrier
【編集部解説】
今回の発見が画期的なのは、大腸がんが免疫療法を回避する「二重の防御壁」という具体的なメカニズムを解明した点にあります。従来から免疫療法は多くのがん種で劇的な効果を示してきましたが、大腸がん、特に転移性のケースでは十分な効果が得られていませんでした。
免疫療法の効果に違いが出る理由を理解するには、大腸がんに大きく2つのタイプがあることを知っておく必要があります。一つは「マイクロサテライト不安定性高頻度(MSI-H)」と呼ばれるタイプで、これは免疫療法が非常によく効きます。実際、ペンブロリズマブという免疫チェックポイント阻害剤を使った臨床試験では、客観的奏効率が31〜55%、2年後も約45%の患者で病勢進行が見られないという優れた成績が報告されています。
しかし問題は、大腸がん患者の大多数を占める「マイクロサテライト安定型(MSS)」のケースです。このタイプでは免疫療法の奏効率がほぼ0〜3%程度と極めて低く、免疫療法の恩恵を受けられる患者は全体のごく一部に限られていました。
今回IRBバルセロナとCNAGの研究チームが明らかにしたのは、MSS型の大腸がんが「なぜ免疫から逃れられるのか」という根本的な問いへの答えです。TGF-βという物質が、まるで二重の城壁のように腫瘍を守っていることを、単一細胞シーケンシング技術を駆使して突き止めました。
第一の壁は「侵入阻止」です。TGF-βは血液中を流れるT細胞(がん細胞を攻撃する免疫細胞)が腫瘍組織に入り込むこと自体を妨げています。第二の壁は「増殖抑制」です。それでも何とか腫瘍内に侵入できた少数のT細胞に対しては、マクロファージという細胞にオステオポンチンというタンパク質を作らせ、T細胞が増えるのを防いでいます。この二段構えの防御により、腫瘍は免疫系から「見えない」状態になっているわけです。
実験では、TGF-βの働きをブロックすると、免疫細胞が腫瘍内に大量に侵入し、攻撃能力を取り戻すことが確認されました。さらに免疫療法と組み合わせることで、極めて強力な抗腫瘍効果が得られたといいます。
ただし、臨床応用には課題も残されています。TGF-β阻害剤の臨床試験はすでに存在しますが、副作用の問題から使用が制限されているのが現状です。過去の試験では、筋肉痛、疲労感、下痢、貧血などの副作用が比較的高頻度で報告されており、中には重篤な肝障害で死亡例も出ています。
そこで研究チームが提案するのが、TGF-βそのものではなく、その下流で働くオステオポンチンの産生を阻害するという代替アプローチです。より標的を絞った戦略により、副作用を抑えつつ同様の効果が得られる可能性があります。
この研究の意義は、単に新しい治療標的を見つけたことだけではありません。腫瘍と免疫系の「対話」を分子レベルで解読し、がんがいかに巧妙に免疫監視をすり抜けているかを明らかにした点にこそ価値があります。こうした基礎的な理解の積み重ねが、将来的により安全で効果的な複合療法の開発につながっていくでしょう。
大腸がんは世界的にがん死亡の主要原因の一つであり、特に転移性のケースでは治療選択肢が限られています。今回の発見により、現在は少数の患者にしか効かない免疫療法が、将来的にはより多くの患者に恩恵をもたらす可能性が開かれました。
【用語解説】
TGF-β(トランスフォーミング増殖因子ベータ)
細胞の増殖、分化、アポトーシスなどを制御するサイトカインの一種。正常細胞では腫瘍抑制因子として働くが、がんが進行すると腫瘍細胞が逆にTGF-βを利用して免疫系を抑制し、転移を促進する。細胞周期のG1期を停止させる作用を持ち、p15やp21といった細胞周期調節タンパク質の合成を促進する。
オステオポンチン(OPN)
骨や様々な組織で発現する細胞外マトリックスタンパク質。がんにおいては腫瘍細胞の増殖、血管新生、転移を促進する役割を果たす。インテグリンやCD44などの受容体と結合し、PI3K/AKT経路などのシグナル伝達を活性化することで、がん細胞の移動や浸潤を助ける。大腸がんでは高発現が進行期、リンパ節転移、予後不良と相関することが報告されている。
T細胞(Tリンパ球)
免疫系の中心的役割を担う白血球の一種。がん細胞を認識して攻撃するCD8陽性細胞傷害性T細胞や、免疫反応を調節するCD4陽性ヘルパーT細胞などがある。免疫療法はこのT細胞の働きを活性化させることでがんを攻撃する治療法である。
マクロファージ
免疫系の細胞で、異物や死んだ細胞を貪食する役割を持つ。腫瘍微小環境では「腫瘍関連マクロファージ(TAM)」として存在し、M1型(抗腫瘍作用)とM2型(腫瘍促進作用)に分類される。がんが進行するとM2型が優勢になり、血管新生や免疫抑制を助けて腫瘍の成長を支援する。
マイクロサテライト不安定性(MSI)
DNAのミスマッチ修復機構の欠損により生じる遺伝子変異のパターン。MSI-H(高頻度)の大腸がんは全体の約15%を占め、免疫療法が非常によく効く。一方、MSS(安定型)は大多数を占めるが免疫療法への反応が乏しい。
免疫チェックポイント阻害剤
T細胞の活性を抑制する分子(PD-1、PD-L1、CTLA-4など)を阻害することで、免疫系ががん細胞を攻撃できるようにする薬剤。ペンブロリズマブ、ニボルマブなどが代表的である。
単一細胞シーケンシング(Single Cell Genomics)
組織内の個々の細胞のゲノムやRNA発現を解析する技術。従来の手法では見えなかった細胞集団の多様性や、特定の細胞タイプの役割を詳細に解明できる最先端技術である。
【参考リンク】
IRB Barcelona(バイオメディカル研究所)(外部)
スペイン・バルセロナの独立系生物医学研究機関。がんや加齢関連疾患研究で世界的評価を得る国際研究センター。
CNAG(国立ゲノム解析センター)(外部)
スペイン・バルセロナのゲノムシーケンシング専門国立機関。がんや希少疾患の診断・治療改善を目的とする。
Nature Genetics(外部)
遺伝学分野の世界最高峰査読付き科学誌。インパクトファクター29.0で遺伝学・遺伝分野191誌中2位。
Eduard Batlle研究室(外部)
IRBバルセロナの大腸がん研究室。ICREA研究教授バトレ博士が率い、大腸がん幹細胞や転移研究で世界をリード。
【参考記事】
Metastatic Colorectal Cancer Blocks Immunotherapy with Dual Barrier(外部)
転移性大腸がんが二重バリアで免疫療法を回避する仕組みを解説。TGF-βの2つの阻害方法を詳述。
【編集部後記】
大腸がんの免疫療法は、一部の患者にしか効果がないという壁にずっとぶつかってきました。でも今回の研究は、その「なぜ効かないのか」を分子レベルで解き明かしてくれています。もし身近な方が治療の選択で悩んでいたら、こうした基礎研究の進展が数年後の選択肢を大きく変えていくかもしれません。
がん治療は日進月歩です。今はまだ臨床試験の段階でも、患者さん一人ひとりに合った治療を見つけるための道筋が、少しずつ見えてきているように感じます。皆さんはどう思われますか?







がもたらす「アンテザード・ソサエティ」の衝撃-300x200.png)





























