2026年2月4日、オランダがん研究所を中心とする研究チームが、遺伝子制御の仕組みを予測する深層学習モデル「PARM」の開発成功を発表しました。この研究成果は科学誌Natureに掲載され、長年の謎とされてきた「遺伝子がいつ、どこで、どの程度の強さでオンまたはオフになるか」という問題の解明に大きく前進したことを示しています。
PARMは、大規模並列レポーターアッセイ(MPRA)という実験技術で生成された数百万のデータを基に訓練された軽量モデルです。既存のAIモデルとは異なり、実験とAIを最初から統合設計することで、特定の細胞タイプにおける遺伝子制御を高精度で予測できます。
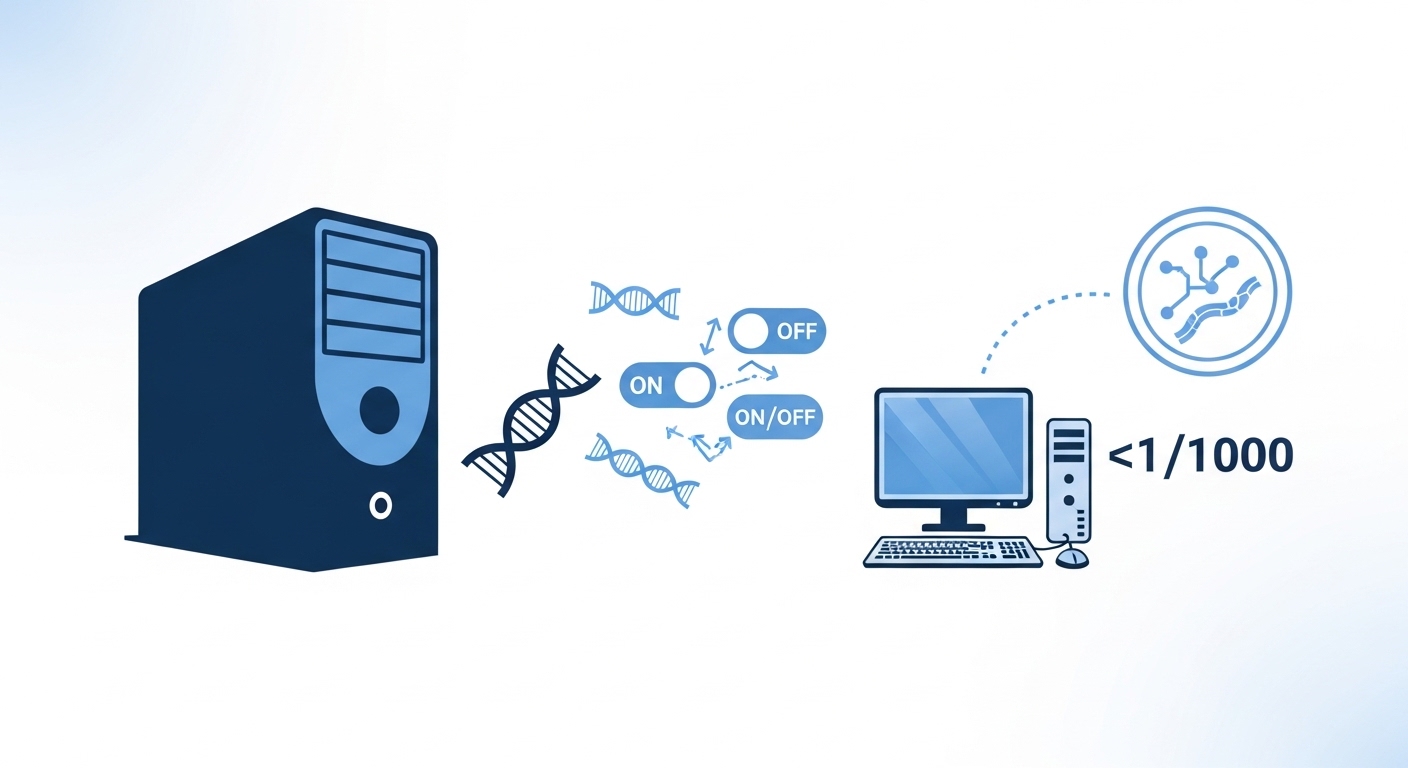
注目すべきは、約1週間前の1月28日に発表されたGoogle DeepMindのAlphaGenomeとの比較です。AlphaGenomeは包括的な予測が可能ですが、PARMはその約1000分の1の計算能力で動作し、一般的な研究室でも使用できます。1つのペトリ皿の細胞と1日の計算時間で、腫瘍細胞などの特定細胞タイプが薬物などの信号にどう応答するかを詳細に解析できます。
この技術により、がん関連変異の多くが存在する非コーディング領域の解釈が可能になり、新しいがん診断、患者の層別化、将来の治療法開発への道が開かれます。
From: ![]() Cracking the rules of gene regulation with experimental elegance and AI
Cracking the rules of gene regulation with experimental elegance and AI
【編集部解説】
遺伝子がいつ、どこで、どの程度の強さでオンまたはオフになるかという「遺伝子制御」の仕組みは、生命科学における最も重要な未解決問題の1つでした。私たちのDNAには約2万個の遺伝子がありますが、それらがどのように制御されているかは、長年謎に包まれていました。
この問題がなぜ重要かというと、がん関連の変異の大半が、タンパク質をコードしない「非コーディング領域」に存在するからです。つまり、従来の遺伝暗号だけでは説明できない領域で病気が発生しているのです。これまで、こうした変異が実際に何をしているのかを解釈することは極めて困難でした。
今回発表されたPARMモデルは、この課題に正面から取り組んでいます。オランダがん研究所を中心とする7つの研究グループが協力し、MPRA(大規模並列レポーターアッセイ)という技術で数百万の測定を行い、そのデータを基にAIモデルを訓練しました。重要なのは、実験とAIを最初から統合設計した点です。既存のデータで学習するのではなく、AI学習に最適化された実験データを生成することで、より正確な予測が可能になりました。
興味深いことに、ほぼ同時期にGoogleのDeepmindもAlphaGenomeという類似のモデルをNatureに発表しています。両者の最も大きな違いは、計算効率とアプローチです。AlphaGenomeは最大100万塩基対の配列を処理できる包括的なモデルですが、膨大な計算リソースを必要とします。一方、PARMはAlphaGenomeの約1000分の1の計算能力で動作し、1つのペトリ皿と1日の計算時間で特定の細胞タイプにおける遺伝子制御を詳細に解析できます。
この違いは実用上、重要な意味を持ちます。AlphaGenomeは最先端のスーパーコンピューターが必要ですが、PARMは一般的な研究室でも使用可能です。特に、細胞タイプごとにカスタマイズされたモデルを構築できる点が、PARMの強みです。たとえば、特定のがん細胞が薬物にどう反応するかを予測したい場合、その細胞タイプに特化したモデルを訓練できます。
両モデルの登場は、遺伝子制御研究における「2つのアプローチ」の価値を示しています。AlphaGenomeは広範囲をカバーする「総合的なツール」、PARMは特定の問題に最適化された「軽量で柔軟なツール」と位置付けられます。
臨床応用の観点では、非コーディング領域の変異を解釈できるようになることで、がん診断の精度向上、患者の層別化、個別化医療の実現につながると期待されています。特に、従来は「意味不明」とされていた遺伝子変異が、実際には遺伝子制御に影響を与えていることを明らかにできる可能性があります。
ただし、両モデルにも限界はあります。PARMは細胞タイプごとに別々のモデルを訓練する必要があり、AlphaGenomeは100キロ塩基対を超える遠距離の制御要素の予測に課題があります。また、どちらも予測の不確実性を正確に報告する技術は発展途上です。
今回の研究が示すのは、実験科学とAIの真の統合です。単にAIにデータを与えるのではなく、AIの学習に最適な実験を設計し、その予測を再び実験で検証するという往復プロセスが、生命科学の新しいパラダイムになりつつあります。
【用語解説】
PARM(Promoter Activity Regulatory Model)
プロモーター活性制御モデル。遺伝子のプロモーター配列からその活性を予測する深層学習モデル。特定の細胞タイプに特化したモデルを構築でき、遺伝子がいつ、どの程度活性化するかを予測する。
遺伝子制御
遺伝子がオンまたはオフに切り替わり、タンパク質の生成量が調整される仕組み。細胞の種類や状態、外部からの刺激に応じて、適切な遺伝子が適切なタイミングで発現するよう制御される。
プロモーター
遺伝子の転写開始点付近に存在するDNA配列で、転写因子が結合して遺伝子の発現を制御する領域。すべての遺伝子に存在する中核的な制御要素。
転写因子
DNAの特定配列に結合し、遺伝子の転写(DNAからRNAへの情報伝達)を促進または抑制するタンパク質。遺伝子制御の重要な担い手。
非コーディング領域
タンパク質をコードしない、人間のゲノムの約98%を占める領域。遺伝子制御に重要な役割を果たすが、その機能解明は困難とされてきた。がん関連変異の多くがこの領域に存在する。
MPRA(大規模並列レポーターアッセイ)
数千から数百万のDNA配列の制御活性を同時に測定できる実験技術。次世代シーケンシングを用いて、各配列が遺伝子発現にどう影響するかを大規模に解析する。
患者の層別化
患者を遺伝的特徴や病態に基づいて分類し、それぞれに最適な治療法を選択するアプローチ。個別化医療の実現に不可欠な概念。
深層学習
多層のニューラルネットワークを用いた機械学習手法。大量のデータからパターンを学習し、複雑な予測や分類を可能にする。
塩基対
DNAを構成する基本単位。アデニン(A)、チミン(T)、グアニン(G)、シトシン(C)の4種類の塩基が対を成す。人間のゲノムは約30億塩基対で構成される。
【参考リンク】
Netherlands Cancer Institute(外部)
オランダを代表するがん研究機関。PARM開発の中心となった研究室が所属している。
Oncode Institute(外部)
オランダの先進的ながん研究ネットワーク。PERICODEプロジェクトを主導した。
Google DeepMind(外部)
AlphaFold、AlphaGenomeなど、AIを用いた生命科学研究で知られる機関。
Nature(外部)
世界最高峰の科学雑誌の一つ。PARM、AlphaGenome両論文が掲載された。
UMC Utrecht(外部)
ユトレヒト大学医療センター。PARMのAI開発を担当した研究グループが所属。
【参考記事】
Regulatory grammar in human promoters uncovered by MPRA-based deep learning | Nature(外部)
PARM論文の原著。10種類の細胞タイプでゲノム全体のプロモーター活性を予測可能にした。
Advancing regulatory variant effect prediction with AlphaGenome | Nature(外部)
AlphaGenomeの原著論文。26の評価タスク中25で既存手法を上回る性能を達成。
AI Model Reveals Predictable Rules of Gene Regulation | Technology Networks(外部)
PARMがAlphaGenomeの約1000分の1の計算能力で動作することを報告。
Scientists Crack the Rules of Gene Regulation – ScienceBlog.com(外部)
PARMとAlphaGenomeの詳細な比較分析。両モデルの限界についても言及。
Deep Learning Model Developed to Help Predict Functional Impact of Regulatory Mutations | GEN(外部)
PERICODEプロジェクトにおける7つの研究グループの協力体制を詳述。
DeepMind releases AlphaGenome source code | STAT News(外部)
AlphaGenomeが160カ国、約3000人の科学者に使用されている状況を報告。
How DeepMind’s genome AI could help solve rare-disease mysteries | Nature(外部)
AlphaGenomeが29の未診断疾患の遺伝的原因解明に活用された事例を紹介。
【編集部後記】
この記事で特筆すべきは、PARMとAlphaGenomeという2つのアプローチが同時期にNatureに発表された点です。一見すると競合関係に見えますが、実は「包括性」と「特化性」という異なる価値を提供しています。
AlphaGenomeは、Googleという巨大な計算リソースを持つ企業だからこそ実現できる「力技」のアプローチです。一方、PARMは限られたリソースでも使える「賢いアプローチ」を示しました。これは、AI研究における重要な教訓を含んでいます。すなわち、「最も強力なモデル」が必ずしも「最も有用なモデル」ではないということです。
実験とAIの統合設計という点も見逃せません。多くのAI研究は「既存のデータを使って何ができるか」という発想ですが、PARMは「AIのために最適なデータを作る」という逆転の発想を採用しました。この手法は、他の科学分野にも応用できる可能性があります。
がん医療への応用という観点では、非コーディング領域の変異解釈が可能になることで、これまで「原因不明」とされてきた多くのケースに光が当たる可能性があります。ただし、予測モデルから実際の治療法開発までには、まだ長い道のりがあることも認識しておく必要があります。
今後もこの分野の発展を注視し、基礎研究がどのように臨床応用へとつながっていくのか、その過程を読者の皆さんと共有していきたいと考えています。





がもたらす「アンテザード・ソサエティ」の衝撃-300x200.png)






























