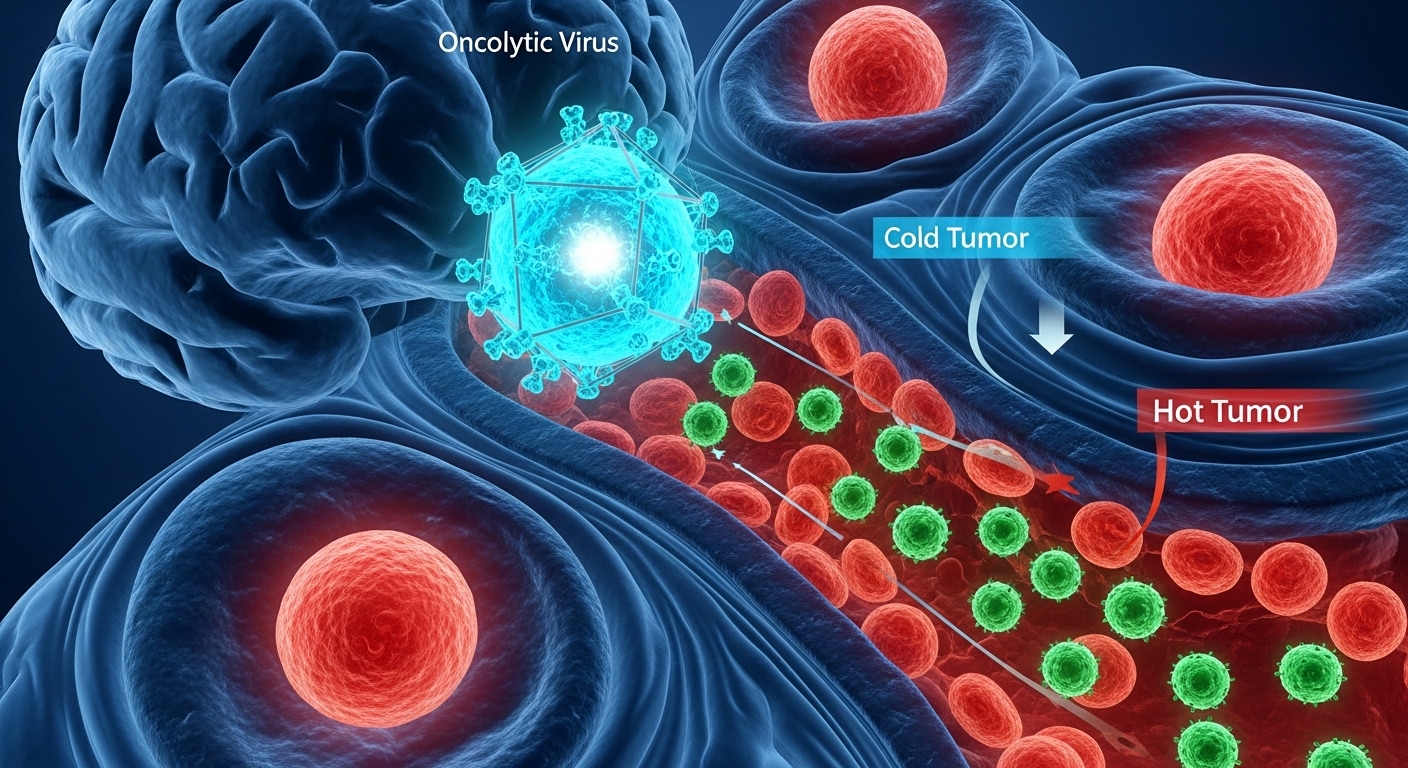
Dana-Farber Cancer InstituteとMass General Brighamの研究チームは、腫瘍溶解性ウイルスによる膠芽腫治療の研究成果を2026年2月11日にCellで発表した。単純ヘルペスウイルスを遺伝子改変したこのウイルスは、膠芽腫細胞内でのみ自己複製し、正常細胞では複製しない。
再発性膠芽腫患者41人を対象としたフェーズ1試験では、1回の注射により免疫T細胞が腫瘍深部に浸潤し、歴史的に報告されている生存期間と比較して延長が確認された。特にウイルス抗体を既に持つ患者で顕著だった。Dana-Farber Cancer Instituteのカイ・ウッチャーフェニッグ医学博士とMass General Brigham Cancer InstituteのE・アントニオ・キオッカ医学博士が共同主任研究者を務めた。
膠芽腫の標準治療は20年間変わっていない。
From: ![]() Virus-Based Therapy Boosts Anti-Cancer Immune Responses to Brain Cancer
Virus-Based Therapy Boosts Anti-Cancer Immune Responses to Brain Cancer
【編集部解説】
膠芽腫は、成人の脳腫瘍の中でも多くみられるがんです。標準治療である手術と放射線療法、化学療法を組み合わせても、中央生存期間はわずか15ヶ月程度。この標準治療は2005年に確立されて以降、実に20年間も進歩がありませんでした。
なぜ膠芽腫の治療は困難なのでしょうか。鍵となるのが「冷たい腫瘍」という概念です。メラノーマや肺がんなど、近年免疫療法が劇的な効果を示してきたがん種では、腫瘍内に免疫細胞が豊富に存在する「熱い腫瘍」の状態にあります。一方、膠芽腫は免疫細胞の浸潤が極めて乏しく、免疫系が腫瘍を認識できない「冷たい」状態なのです。
この状況を打開する可能性を示したのが今回の研究です。使用されたCAN-3110という腫瘍溶解性ウイルスは、単純ヘルペスウイルスを遺伝子改変したものですが、その設計には巧妙な工夫が施されています。通常の臨床用腫瘍溶解性ウイルスが安全性のために削除している「ICP34.5」という遺伝子を、あえて残しているのです。
ただし、このICP34.5遺伝子は「ネスチン」というタンパク質のプロモーター制御下に置かれています。ネスチンは膠芽腫細胞で高発現する一方、成人の正常脳組織ではほとんど発現しません。この巧妙な設計により、ウイルスは膠芽腫細胞内でのみ活発に増殖し、正常な脳細胞では増殖できないのです。
今回の研究で特に注目すべきは、単なる生存期間の延長にとどまらず、そのメカニズムが明らかになった点にあります。ウイルス投与後の腫瘍組織を詳細に分析した結果、細胞傷害性T細胞が腫瘍深部に長期間浸潤し続けていることが確認されました。つまり、ウイルスが「冷たい腫瘍」を「熱い腫瘍」に変換することに成功したのです。
興味深いのは、既にヘルペスウイルスに感染したことがある患者、すなわちHSV1抗体を持つ患者で特に効果が高かった点です。これは免疫系が既にヘルペスウイルスに対して「訓練」されており、ウイルスが腫瘍内で免疫反応を引き起こすと、より迅速かつ強力に応答できるためと考えられます。単純ヘルペスウイルス1型(HSV1)は成人の多くが感染歴を持つウイルスであり、この治療の恩恵を受けられる患者層は相当数存在すると考えられます。
ただし、課題も残されています。今回はフェーズ1試験であり、41人という限られた患者数での結果です。また、ウイルスを直接腫瘍内に注射する必要があるため、手術が必要となります。現在、4ヶ月間で最大6回の投与を行う次のフェーズの臨床試験が進行中であり、複数回投与による効果の向上が期待されています。
この技術が持つ意義は、膠芽腫治療にとどまりません。多くの固形がんが膠芽腫と同様に免疫抑制的な微小環境を持っており、免疫療法への抵抗性を示します。腫瘍溶解性ウイルスによって「冷たい腫瘍」を「熱い腫瘍」に変換するアプローチは、他のがん種にも応用できる可能性を秘めています。実際、研究チームは将来的に他の固形がんや、免疫チェックポイント阻害剤との併用療法の検討も視野に入れています。
20年間停滞していた膠芽腫治療の扉が、ようやく開き始めたと言えるでしょう。
【用語解説】
腫瘍溶解性ウイルス(おんこりティックウイルス)
がん細胞に選択的に感染し、増殖しながら破壊する遺伝子改変ウイルス。正常細胞では増殖できないように設計されており、がん細胞を直接破壊するだけでなく、死滅したがん細胞から放出される抗原によって免疫系を活性化させる二重の作用を持つ。
膠芽腫(こうがしゅ、グリオブラストーマ)
成人の脳腫瘍の中で最も頻度が高く、最も悪性度の高い原発性脳腫瘍。浸潤性が高く完全切除が困難で、標準治療を行っても中央生存期間は約15ヶ月と予後が極めて不良。WHO分類でグレード4に分類される。
冷たい腫瘍/熱い腫瘍
腫瘍の免疫学的状態を表す概念。「冷たい腫瘍」は免疫細胞の浸潤が少なく免疫療法が効きにくい状態を、「熱い腫瘍」は免疫細胞が豊富に存在し免疫療法が効果を発揮しやすい状態を指す。膠芽腫は典型的な冷たい腫瘍とされる。
細胞傷害性T細胞(さいぼうしょうがいせいティーさいぼう)
がん細胞やウイルス感染細胞を認識して直接攻撃・破壊する免疫細胞。CD8陽性T細胞とも呼ばれ、がん免疫療法における主要な抗腫瘍効果を担う。
フェーズ1試験
新薬や新しい治療法の臨床試験の第一段階。主に安全性、忍容性、適切な投与量の決定を目的とし、通常は少数の患者を対象に実施される。有効性の評価は副次的な目的となる。
ICP34.5
単純ヘルペスウイルスが持つ神経毒性遺伝子。ウイルスの増殖能力を高める一方、正常な脳細胞に対して毒性を示す。CAN-3110ではこの遺伝子をネスチンプロモーター制御下に置くことで、腫瘍選択的な複製を実現している。
ネスチン
神経幹細胞や未分化細胞で発現する中間径フィラメントタンパク質。膠芽腫などの悪性脳腫瘍で高発現する一方、成人の正常脳組織ではほとんど発現しないため、腫瘍特異的プロモーターとして利用される。
【参考リンク】
Dana-Farber Cancer Institute(外部)
米国ボストンに拠点を置く世界有数のがん専門医療機関。がん研究と治療において国際的に高い評価を得ている。
Mass General Brigham(外部)
マサチューセッツ総合病院等を中心とする統合医療システム。米国最大級の学術医療ネットワークの一つ。
Cell (学術誌)(外部)
1974年創刊の生命科学分野における世界最高峰の査読付き学術誌。革新的な研究成果が掲載されることで知られる。
Candel Therapeutics(外部)
腫瘍溶解性ウイルス療法を専門とするバイオテクノロジー企業。CAN-3110の臨床開発を進めている。
Nature (学術誌)(外部)
1869年創刊の世界で最も権威ある総合科学学術誌。CAN-3110の初期臨床試験結果が2023年に掲載された。
【参考記事】
Clinical trial links oncolytic immunoactivation to survival in glioblastoma(外部)
Nature誌2023年11月掲載の原著論文。41人の患者を対象としたCAN-3110のフェーズ1臨床試験結果を報告。
Immunotherapy for glioblastoma: current state, challenges, and future perspectives(外部)
2024年10月の包括的レビュー論文。膠芽腫が「冷たい腫瘍」である理由と免疫療法の課題について議論。
A single oncolytic virus injection may help T cells infiltrate glioblastoma(外部)
2026年2月11日付の報道記事。今回のCell論文を基に、単回注射による効果を解説している。
Can Immunotherapy Succeed in Glioblastoma?(外部)
米国国立がん研究所による2018年の解説。腫瘍溶解性ウイルスで「冷たい腫瘍」から「熱い腫瘍」への転換を報告。
【編集部後記】
20年間停滞していた膠芽腫治療に、新たな光が差し込み始めています。「冷たい腫瘍」を「熱い腫瘍」に変えるというアプローチは、膠芽腫だけでなく、免疫療法が効きにくいとされる多くのがん治療に応用できる可能性を秘めています。
今回の研究が示したのは、ウイルスという「自然界の敵」を味方につけることで、私たちの免疫系を目覚めさせるという発想の転換でした。みなさんは、こうした腫瘍溶解性ウイルス療法が今後どのように進化していくと思われますか。複数回投与や他の免疫療法との併用など、次の展開にも注目していきたいですね。